华龛生物CDMO助力细胞治疗产品商业化 | 细胞GMP生产环境篇
- 分类:新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-08-19
- 访问量:115
【概要描述】与大多数小分子药物和许多生物药物不同,CGT产品的主要形式包括基因治疗载体、溶瘤病毒产品、细胞产品(如CAR-T、NK细胞、干细胞)等,涉及的上游工艺开发服务可拆分为质粒、病毒、细胞的生产工艺等三个相对独立的环节。
因此CGT产品通常在独特的制造环境中生产,其GMP厂房应根据各自工艺的特点进行设计和建造,同时要适应未来不断变化的工艺改进和技术要求,满足当前和未来需求的商业化GMP生产能力。
华龛生物CDMO助力细胞治疗产品商业化 | 细胞GMP生产环境篇
【概要描述】与大多数小分子药物和许多生物药物不同,CGT产品的主要形式包括基因治疗载体、溶瘤病毒产品、细胞产品(如CAR-T、NK细胞、干细胞)等,涉及的上游工艺开发服务可拆分为质粒、病毒、细胞的生产工艺等三个相对独立的环节。
因此CGT产品通常在独特的制造环境中生产,其GMP厂房应根据各自工艺的特点进行设计和建造,同时要适应未来不断变化的工艺改进和技术要求,满足当前和未来需求的商业化GMP生产能力。
- 分类:新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-08-19
- 访问量:115
与大多数小分子药物和许多生物药物不同,CGT产品的主要形式包括基因治疗载体、溶瘤病毒产品、细胞产品(如CAR-T、NK细胞、干细胞)等,涉及的上游工艺开发服务可拆分为质粒、病毒、细胞的生产工艺等三个相对独立的环节。
因此CGT产品通常在独特的制造环境中生产,其GMP厂房应根据各自工艺的特点进行设计和建造,同时要适应未来不断变化的工艺改进和技术要求,满足当前和未来需求的商业化GMP生产能力。
细胞治疗产品由于其个体差异大、终产品无法消毒灭菌、生产周期长等特点,只能依靠过程控制来保证其终产品的安全性,生产环境和设施的空气清洁度水平应与产品和生产操作相适应,生产环境和设施不得对原材料、中间体和成品造成污染。
本文仅就MSCs产品工艺流程所涉及的工艺平面和厂房设施的设计,及如何进行规模化制备以满足GMP商业制造的需求进行讨论。
MSCs 治疗产品应遵循 GMP 指南,按照 IND 法规和质量要求生产药品,GMP厂房设计是MSCs产品生产的基础,用于确保 MSCs 产品的持续生产和控制在适合临床使用的最先进的质量标准。MSCs细胞治疗产品的生产工艺流程,主要分为如下几个不同阶段:
▮供者选择和评估(异体MSCs产品);
▮组织样本的接收、分离处理;
▮原代细胞的制备;
▮种子细胞库的建立;
▮细胞体外扩增获得预期的细胞数量;
▮中间产品建立工作细胞库;
▮最终制剂产品的制备、鉴定、包装和放行等。

据此在GMP生产车间的功能划分上,以华龛生物3D细胞智造与再生医学中心——3D FloTrix®细胞技术平台为例,可以分为以下几个功能区:
1、样本、物料接收区:
用于经医疗机构采集并检验符合接收及注册标准的组织样本的接收和登记,并传递到缓冲区。缓冲区主要用于组织样本的初步处理、原辅料的暂存,需配备冰箱以满足温度对供者材料和产品质量的要求,洁净级别满足C级即可。
2、细胞操作区:
目前细胞治疗产品生产操作环境的洁净度级别按照《药品生产质量管理规范——细胞治疗产品附录》可分为以下级别:
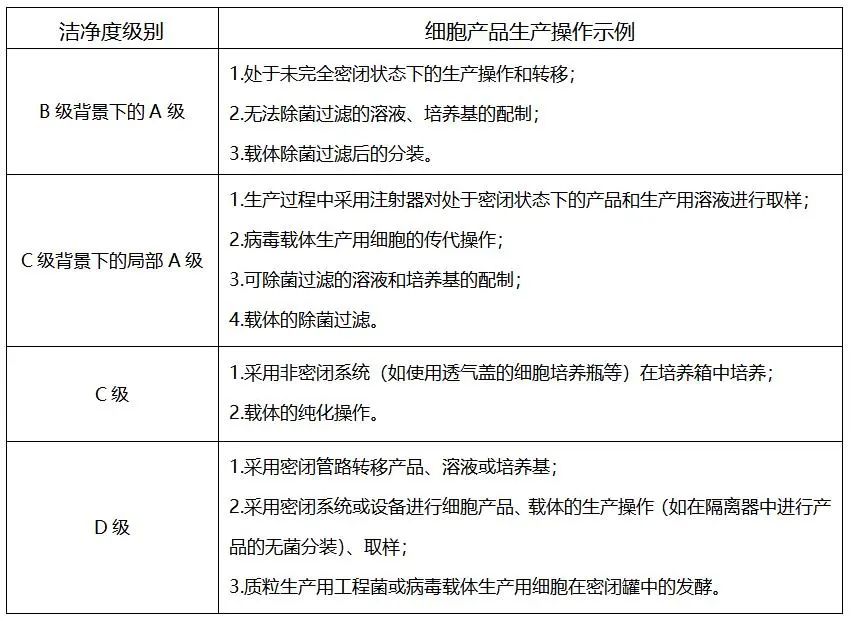
现阶段细胞治疗企业常见的MSCs治疗产品生产环境洁净度等级可分为B+A和C+A。如采用传统二维贴壁细胞操作培养方式,B+A是大家首先考虑的生产环境实现形式,房间洁净级别为B级。由于存在培养瓶/细胞工厂等非全封闭操作,需要在生物安全柜A级条件下进行,然后在CO2培养箱内进行细胞培养,但这种方式也不能保证全程在A级环境下完成。随着细胞治疗产品的生产设备向全封闭、自动化发展及无菌隔离器的应用,对生产环境的要求也将降低,洁净级别也可由B级降低为C级或D级,可以将离心、培养等关键环节集成在隔离器内,实现全程的A级隔离。




华龛生物3D FloTrix®细胞技术平台实景
华龛生物的细胞操作区,主要用于不同组织来源MSCs细胞产品的生产操作,区域划分为原代细胞分离制备室、细胞扩增培养室及细胞制剂制备室。生产环境洁净度等级分为全流程的B+A和C+A两种级别,根据二维及三维培养工艺的特点,满足不同客户对于洁净等级的需求。华龛生物3D FloTrix®vivaSPIN生物反应器是华龛自主研发的一款封闭式、自动化、规模化的搅拌式生物反应器,结合华龛生物3D FloTrix®vivaPREP细胞收获系统,根据特定的细胞类型及工艺要求,可在C级环境下实现从细胞接种、培养扩增、细胞收获分装的连续、密闭式生产工艺,提高单批次细胞产量,显著降低生产成本,减少因细胞反复制备所带来的批次间质量不稳定性风险。




华龛生物3D FloTrix®细胞技术平台实景
3、工艺辅助区:
在GMP各功能区的设计时,应充分考虑洁净气体、纯水、供电、医疗废物处理、清洗消毒灭菌、净化空调系统、环境监测系统等设施定位和维护符合其预期的目的和用途,以保证MSCs 产品的生产环境和设施的清洁、消毒、维护和监测操作受到定期验证和持续受制。
▮MSCs 产品不能最终灭菌和过滤除菌,若工艺过程中用量不大,可使用外购的无菌水和试剂;
▮洁净区工作服的清洗、生产用的器具清洗和洁净区的清洁均应采用纯化水;
▮需要为关键设备提供UPS电源,比如细胞分离和扩增设备、CO2培养箱、冰箱、关键的分析仪器等;
▮进出B级区的生产器具及医疗废物等均需要使用湿热灭菌柜进行灭菌;
▮洁净区与非洁净区之间、不同洁净级别洁净区之间压差应不低于10 Pa;
▮3D FloTrix®工艺用气涉及空气、氧气、氮气、二氧化碳的使用,气体管道设计采用单向流,末端除菌过滤装置完整性均定期检查;
▮华龛生物的细胞操作间设计为单向流,废弃物的退出通道与产品和生产物料的洁净通道分开,设立独立的废弃物走廊和废物灭活房间,最大限度地减少交叉污染。
4、质量控制区和储存区:
华龛生物质控区包括细胞培养检测室、理化检测室、分子检测室、阳性对照室、无菌检测室等,涉及支原体、内毒素、无菌、微生物限度、阳性对照、流式细胞仪和分子生物学等相关检测,可满足MSCs细胞治疗产品各项质量检测项目的要求。储存区包括各级细胞库及试剂、耗材的储存,液氮存储区要充分考虑楼层荷载承重。
细胞治疗产品基于产品特性,决定了工艺流程设计的复杂性和辅助系统的特殊要求,其生产车间的工艺布局和厂房设施,应充分考虑场地选择、生产品种和批次、工艺、产品研发生产阶段等因素,合理合规的厂房设计才能确保产品的安全性、合法性。
华龛生物3D细胞智造与再生医学中心目前已构建起完整的GMP质量管理体系,内容涵盖了生产管理、质量控制与质量保证、厂房与设施、物料与产品、确认与验证、委托生产与委托验证、产品发运与召回、自检等。

所有生产及质量控制人员均经过系统的培训,严格按照质量管理体系要求进行生产、记录、检验工作,实现了生产全过程的可追溯管理,满足干细胞治疗产品临床前CDMO工艺开发及服务的需求。
参考:
1. 2022《药品生产质量管理规范——细胞治疗产品附录》
下期预告:细胞三维培养设备耗材篇
欲知详情如何 敬请关注华龛生物
【关于华龛生物】
北京华龛生物科技有限公司由清华大学医学院杜亚楠教授科研团队领衔创建,清华大学参股共建。核心技术源于清华大学的科技成果转化。公司专注于打造原创3D细胞“智造”平台,提供基于3D微载体的细胞规模化定制化扩增工艺整体解决方案。
华龛生物核心产品3D TableTrix®微载片(微载体),是自主创新型、首款可用于细胞药物开发的药用辅料级微载体。已通过中检院等相关权威机构的检验报告,并获得2项国家药监局药用辅料资质(CDE审批登记号:F20210000003、F20200000496)。同时,产品获得美国FDA DMF药用辅料资质(DMF:35481)。
华龛生物的产品与服务,可广泛应用于基因与细胞治疗、细胞外囊泡、疫苗及蛋白产品等生产的上游工艺开发。同时,在再生医学、类器官与食品科技(细胞培养肉等)领域也具有广泛应用前景。
公司拥有5000平米的研发与转化平台,其中包括4000平米的GMP生产平台,1000余平的以3D细胞智造及微组织再生医学治疗产品为核心的CDMO服务平台;新建1200L微载体生产线。相关技术已获得100余项专利成果,30余篇国际期刊报道。核心技术项目已获得多项国家级立项支持与应用。

扫二维码用手机看
推荐新闻
-
电话
- 服务热线400-012 6688
-
E-mail
- E-mailmarketing@cytoniche.com
- TOP
 京公网安备 11010802037749号
京公网安备 11010802037749号



