JEV丨一些研究中报道的EV功能可能是由于转染试剂的污染!
- 分类:新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-10-21
- 访问量:282
【概要描述】细胞外囊泡(EV)是细胞通讯和生理的重要介质。通过瞬时转染质粒DNA到靶细胞中,可以产生出特定蛋白质或核酸修饰的EV。然而,DNA转染试剂复合物(DTC)的大小与EV大致相同,传统的超离纯化可能无法分离这两种物质,并且DTC产生的活性可能会与EV活性相混淆。
JEV丨一些研究中报道的EV功能可能是由于转染试剂的污染!
【概要描述】细胞外囊泡(EV)是细胞通讯和生理的重要介质。通过瞬时转染质粒DNA到靶细胞中,可以产生出特定蛋白质或核酸修饰的EV。然而,DNA转染试剂复合物(DTC)的大小与EV大致相同,传统的超离纯化可能无法分离这两种物质,并且DTC产生的活性可能会与EV活性相混淆。
- 分类:新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-10-21
- 访问量:282
以下文章来源于外泌体之家(公众号)
细胞外囊泡(EV)是细胞通讯和生理的重要介质。通过瞬时转染质粒DNA到靶细胞中,可以产生出特定蛋白质或核酸修饰的EV。然而,DNA转染试剂复合物(DTC)的大小与EV大致相同,传统的超离纯化可能无法分离这两种物质,并且DTC产生的活性可能会与EV活性相混淆。来自Codiak BioSciences公司的研究人员发现,差速超速离心(一种常用的EV分离程序)不能将EV与瞬时转染细胞的细胞培养上清液中的DTC分离。因此,一些研究报告的EV活性可能是由于转染试剂的污染,而不是EV介导的货物输送,这表明了对EV样品进行严格纯化和表征的必要性。相关研究以“Transfection reagent artefact likely accounts for some reports of extracellular vesicle function”为题于10月10日在J Extracell Vesicles杂志上发表。
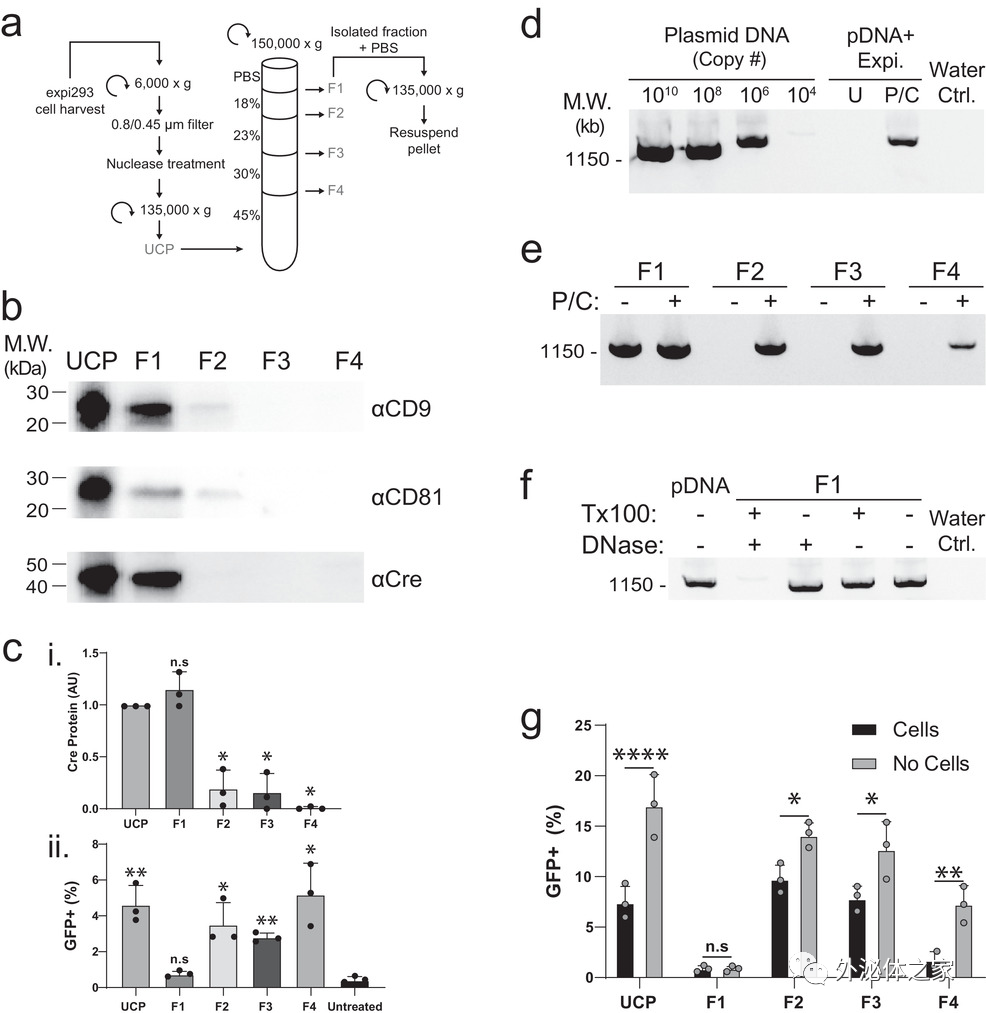
图:Cre转染后细胞分泌的超速离心颗粒(UCP)中存在的Cre活性不全部来源于EV。(A)将从转染了Expifectamine的细胞中分离出的UCP分离为四个组分(F1-4)。(B)用抗Cre抗体和EV标记物CD9和CD81对UCP和密度梯度组分进行Western blot分析。(C)蛋白质印迹密度法定量Cre蛋白(i)。(ii)用50μM氯喹和UCP或F1-4处理3天后,通过流式细胞仪分析GFP+报告细胞的定量。(D-F)琼脂糖凝胶用DNA染料染色,显示样本的PCR扩增。(G)用50μM氯喹和UCP或F1-4处理的GFP+报告细胞的定量。对于无细胞条件,在Cre质粒瞬时转染中没有细胞的情况下,进行模拟转染。
细胞外囊泡(EV)是由迄今为止被检测的所有细胞释放,与多种生理和病理过程有关。EV可以通过EV表面分子(蛋白质、聚糖或脂类)与受体细胞表面受体的相互作用,或通过向受体细胞输送货物来介导其对受体细胞的影响。虽然EV货物运输的确切机制尚不清楚,但利用EV自带的天然通信网络对于开发EV疗法具有特别重要的意义。
近年来,许多研究已经证明EV能够运送多种货物,包括DNA、RNA和蛋白质。然而,不同研究中的EV传送效率和程度差异很大,可能是由于EV来源、生产方法、分离方法和所用报告系统的不同。特别是,关于EV传递核苷酸能力的报道差异很大,一些报道称EV介导的RNA敲除功能很强大,而另一些报道称没有可识别的功能传递。类似地,报道的蛋白质传递效率范围不确定,从高水平Cre到低水平传递Cre、Cas9和姜黄素都有。在许多情况下,研究报告的EV的作用不大,这可能需要更灵敏的报告系统来检测。然而,这些报告系统的敏感性可能使其容易受到人为因素的影响,重要的是要确保包括适当的控制,以排除非EV来源的物质的干扰。
最近有研究报道称,通过装载Cre重组酶的EV用于编辑一个报告细胞系,并且在增强DNA转染试剂复合物的内体途径逃逸药物(如氯喹)的存在下,这种基因编辑活性显著增加。研究人员通过以下相同的程序复制了这一发现:用EV靶向的Cre去转染细胞,然后通过差速超速离心纯化该细胞分泌的EV,并用再重悬的超速离心颗粒(UCP)处理报告细胞。虽然研究人员能够检测到含有EV的UCP样本中的Cre活性,但也观察到Cre蛋白水平与Cre活性水平并不相关,这与之前其他课题组观察到的情况类似。
因此研究人员认为,当使用瞬时转染并进行标准的EV纯化时,EV在报告细胞的基因编辑中实际上是可有可无的;相反,Cre活性是由于DNA转染试剂复合物(DTC)与UCP中的EV共同纯化出来而造成的。研究数据证明,EV靶向的Cre重组酶的生物活性是由于质粒DNA的污染,而不是EV介导的Cre蛋白传递。尽管DTC在电荷和密度方面与EV在生物物理学上有所不同,但它们在大小上相似,因此某些纯化方法(如差速超速离心)不太可能分离这两种类型。通常采取的从EV样本中去除质粒DNA的步骤是介质交换和核酸酶处理,但在这种情形下是无效的。由于这些细胞分析中质粒DNA的有害性质,因此一些关于EV功能的研究可能是DTC污染样本产生的功能。EV和DTC可以通过密度梯度超速离心分离,这突出了在使用EV生产时,如果通过瞬时转染来检测EV功能时,一定要确保消除DTC。
参考文献: Transfection reagent artefact likely accounts for some reports of extracellular vesicle function. J Extracell Vesicles. 2022;11(10):e12253.
【华龛生物】
北京华龛生物科技有限公司由清华大学医学院杜亚楠教授科研团队领衔创建,清华大学参股共建。核心技术源于清华大学的科技成果转化。公司专注于打造原创3D细胞“智造”平台,提供基于3D微载体的细胞规模化定制化扩增工艺整体解决方案。
华龛生物核心产品3D TableTrix®微载片(微载体),是自主创新型、首款可用于细胞药物开发的药用辅料级微载体。已通过中检院等相关权威机构的检验报告,并获得2项国家药监局药用辅料资质(CDE审批登记号:F20210000003、F20200000496)。同时,产品获得美国FDA DMF药用辅料资质(DMF:35481)。
华龛生物的产品与服务,可广泛应用于基因与细胞治疗、细胞外囊泡、疫苗及蛋白产品等生产的上游工艺开发。同时,在再生医学、类器官与食品科技(细胞培养肉等)领域也具有广泛应用前景。
公司拥有5000余平米的研发与转化平台,其中包括1000余平的以3D细胞智造及微组织再生医学治疗产品为核心的CDMO服务平台;还拥有4000平米的GMP生产平台,并新建1200L微载体生产线。相关技术已获得100余项专利成果,30余篇国际期刊报道。核心技术项目已获得多项国家级立项支持与应用。

扫二维码用手机看
推荐新闻
-
电话
- 服务热线400-012 6688
-
E-mail
- E-mailmarketing@cytoniche.com
- TOP
 京公网安备 11010802037749号
京公网安备 11010802037749号



