以下文章来源于干细胞者说(公众号)
间充质干细胞的扫描电镜图 Steve Gschmeissner/SPL
“你之所以活着,是因为你不断地更新各种组织和器官,或让它们恢复活力。在体内,皮肤、肠道和血液等细胞逐渐成熟,在一段时间内发挥功能,然后过期,被不断更新的细胞取代,从而更新组织。在每一个发生这种年轻化过程的组织中,都存在一个产生这些分化细胞的来源。这个来源被称为 ‘干细胞’。”
美国生物学家 Arnold Caplan 在他的主页上这样写道
上一期我们简述了间充质干细胞产品开发的第二道技术壁垒:给药方式的选择。在保证细胞产品质量的情况下,通过选择合适的给药途径,可以保证一定的临床有效性。
回顾上文:间充质干细胞产品开发技术壁垒:产品异质性
回顾上文:间充质干细胞产品开发技术壁垒:给药方式
间充质干细胞产品要发挥疗效,针对患者的有效评估也是一个重要因素。如果提前评估,并对不同病程的患者采取相应措施,可以增强间充质干细胞的临床效果。
-01-
患者的细胞毒性反应
2017年,Galleu等发表了一项研究,发现一种影响静脉注射的间充质干细胞免疫抑制效果的可能存在的机制,而这种机制与细胞产品的CQA(即IDO和TNF-β受体表达)关系不大。那么和啥有关,显而易见,和患者本身有关!
在其他疾病中,也发现了患者免疫应答在治疗中的重要作用。例如,国际知名杂志《自然》刊登的一项治疗心肌缺血的研究表明,间充质干细胞治疗心脏疾病不是通过产生新的心肌细胞,而是由于患者体内CCR2+和CX3CR1+巨噬细胞介导的急性免疫应答(非细菌引起)。
患者疾病情况
除了细胞毒性反应,与患者疾病相关的微环境也可影响间充质干细胞的治疗效果。在某些适应症中,早期治疗可达到最大的治疗效果,要优于晚期治疗。
Athersys公司开展一项临床试验2期(NCT01436487),MSCs产品Multistem用于治疗缺血性卒中。虽然临床结果是失败的,因为在神经功能方面没有改善。但回顾分析显示,与卒中发作36-48小时治疗的患者相比,卒中发作36小时内的患者接受治疗的预后有所改善。为了充分利用Multistem再生能力的时间依赖性,接下来的临床试验3期(NCT03545607)将选择卒中后36小时内进行。
临床前研究表明,间充质干细胞进入机体后,所处的组织微环境可能是不同疾病发展阶段治疗效果的一个重要因素。疾病微环境中的炎症,缺氧和ECM是动态的,并且都可以影响进入体内间充质干细胞的功能。
-
首先,当炎症高时,MSCs抑制GVHD的能力似乎更高,而炎症低时,MSCs的抑制力更低。 -
其次,缺氧条件下的MSCs可分泌各种活性分子,并增强血管生成和再生能力。 -
第三,与在软性的胶原蛋白3D支架中植入的MSCs相比,植入在硬性表面上的MSCs 降低了异体淋巴细胞活化的抑制作用。ECM的刚度与纤维化疾病的严重程度呈正相关,在患者之间差异很大。
随着炎症,缺氧和ECM的变化,T细胞受损数量的增加也可能影响间充质干细胞在体内的治疗效果。例如,GVHD中的效应T细胞从疾病早期的不可检测增加到晚期的90%。因此,针对晚期GVHD患者,输注同样数量的间充质干细胞,就会显得相对不足,因为实际上患者体内的效应T细胞更多。
患者疾病状态的合理评估,将有助于优化给药方案,并改善对间充质干细胞的临床预测。
患者其他因素
另外,还有一些因素,也可能影响间充质干细胞向疾病部位的募集,进而影响治疗结果。例如,毛细血管(直径:约10~15μm)会捕获静脉输注的间充质干细胞(直径~20μm),也就是说间充质干细胞很容易很卡住,影响了间充质干细胞归巢至靶细胞器官的能力。此外,间充质干细胞归巢依赖趋化因子的分泌,因为宿主中靶器官的趋化因子分泌的量,可能不足以有效地募集间充质干细胞。
02-
不同疾病状态患者的解决方案
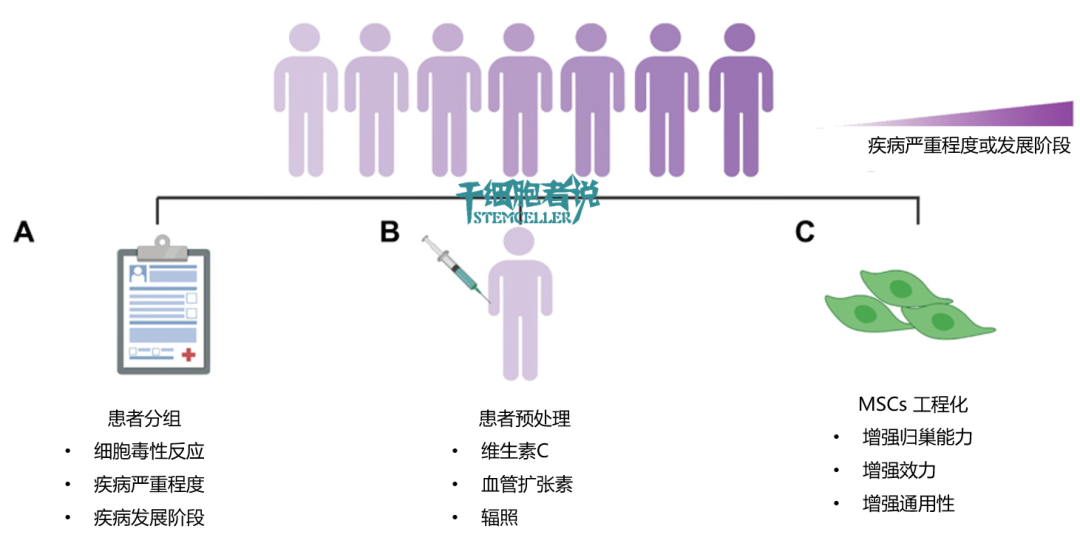
图1. 与患者选择相关的解决方案
A) 患者分组。基于患者针对MSCs的细胞毒性反应/疾病严重程度/发展阶段,可用于精准招募能够从MSCs治疗中获益的患者。
B) 患者预处理。用维生素C刺激宿主可以清除自由基;用血管扩张剂或照射,可促使MSCs归巢到病灶处,从而增强治疗效果。
C) MSCs工程化。MSCs可以被设计成增强归巢能力,增强效力,或设计成不受宿主微环境影响而发挥功能。
患者分组
患者进行精准分组,缩小适应症范围是一个简单而有效的策略。基于患者对间充质干细胞的细胞毒性反应和疾病发展程度的等,对患者进行精准分组是改善临床疗效的简单策略。细胞毒性反应的评估,可以通过将间充质干细胞与患者的PBMC共培养,并通过在细胞毒性试验中测试PBMC诱导间充质干细胞凋亡的能力来实现。
对“患者”预处理
尽管宿主预处理仍处于临床前阶段,但提前对患者施用维生素C预处理,辐射处理,血管舒张等研究,可能代表了一种增强间充质干细胞效力的新策略。
▉ 维生素C处理
改造患者体内组织微环境,是提高间充质干细胞效力和响应速度的另一条途径。例如,维生素C具有防止氧化,从而减少对移植细胞的损害的能力。在脊髓损伤模型中,与单独使用间充质干细胞或维生素C相比,腹膜内注射维生素C并在脊髓损伤部位局部注射间充质干细胞具有更好的治疗效果。
静脉输注间充质干细胞前,可先对患者使用血管扩张素,避免间充质干细胞在患者毛细血管的滞留。临床前研究表明,使用血管扩张剂,肺部间充质干细胞的积聚减少了15%,间充质干细胞向骨髓的归巢增加了10%至50%。
增强患者靶器官的趋化因子分泌,也可提高间充质干细胞归巢。临床前研究表明,在静脉输注间充质干细胞前,经辐照的动物体内的间充质干细胞归巢至骨髓的数量,比未辐照增加了两倍。其机理是,辐照增加了动物受损骨髓部位SDF-1的分泌,这促进了受辐照人群中间充质干细胞归巢的改善。
间充质干细胞工程化
理解体内微环境对间充质干细胞治疗的影响,有助于我们开发间充质干细胞工程化的新方法。改造间充质干细胞分泌组,增强其通用性,使其可独立于患者组织微环境发挥作用。比起天然的间充质干细胞,过表达抗炎因子(IL-10或IL-35)的间充质干细胞已被证明治疗效果更好。通过在促炎环境中分泌更多的抗炎因子,间充质干细胞可更有效地减轻炎症,增强治疗效果。
-03-
间充质干细胞面临的巨大挑战
-04-
小结与展望
间充质干细胞治疗的成功因素,除了要保证细胞产品的质量,还应对患者适应症本身有透彻的了解,同时采用正确的给药途径,以及给予合适的剂量。
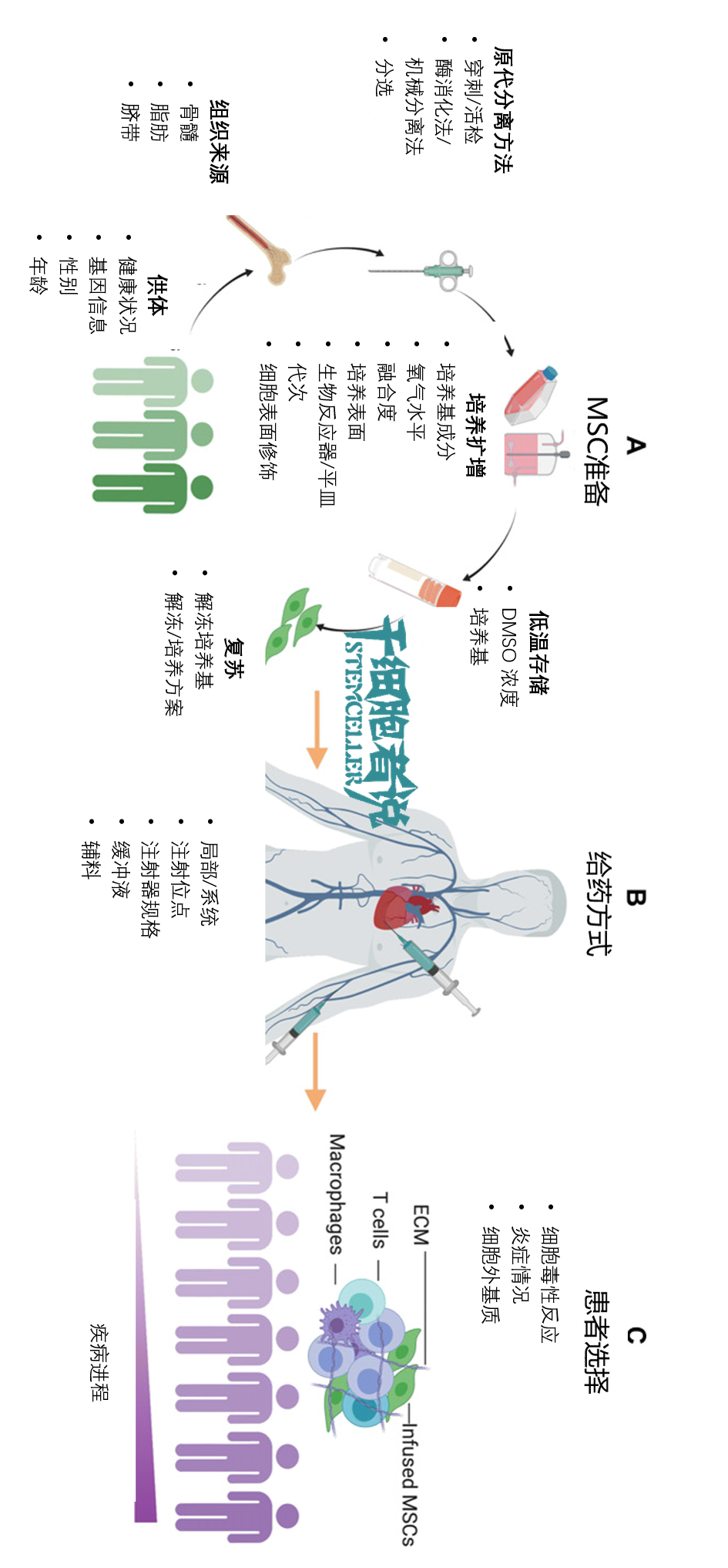
图2. 间充质干细胞治疗面临的巨大挑战
当临床需要大剂量的间充质干细胞时,工艺开发尤为重要。研发人员必须克服间充质干细胞规模化生产的障碍,可以根据细胞药物的自身特性(如自体/异体,剂量,剂型,规模),选择合适的生产工艺。
目前,由于每个临床应用都需要一个定制的、个性化的工艺流程,生产这些细胞产品的成本很高。质量控制标准共识的缺失,也阻碍了细胞制备工艺的标准化进程,评估产品的安全性和有效性仍然具有挑战性。
主要文献:后台索取 联系微信:shui2900
【华龛生物】
北京华龛生物科技有限公司由清华大学医学院杜亚楠教授科研团队领衔创建,清华大学参股共建。核心技术源于清华大学的科技成果转化。公司专注于打造原创3D细胞“智造”平台,提供基于3D微载体的细胞规模化定制化扩增工艺整体解决方案。
华龛生物核心产品3D TableTrix®微载体(片剂),是自主创新型、首款可用于细胞药物开发的药用辅料级微载体。已通过中检院等相关权威机构的检验报告,并获得2项国家药监局药用辅料资质(CDE审批登记号:F20210000003、F20200000496)。同时,产品获得美国FDA DMF药用辅料资质(DMF:35481)。
华龛生物的产品与服务,可广泛应用于基因与细胞治疗、细胞外囊泡、疫苗及蛋白产品等生产的上游工艺开发。同时,在再生医学、类器官与食品科技(细胞培养肉等)领域也具有广泛应用前景。
公司拥有5000余平米的研发与转化平台,其中包括1000余平的以3D细胞智造及微组织再生医学治疗产品为核心的CDMO服务平台;还拥有4000平米的GMP生产平台,并新建1200L微载体生产线。相关技术已获得100余项专利成果,30余篇国际期刊报道。核心技术项目已获得多项国家级立项支持与应用。

扫二维码用手机看
推荐新闻
-
电话
- 服务热线400-012 6688
-
E-mail
- E-mailmarketing@cytoniche.com
- TOP
 京公网安备 11010802037749号
京公网安备 11010802037749号



