高质量三维外泌体规模化生产整体解决方案
- 分类:公司新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-07-05
- 访问量:628
【概要描述】外泌体(Exosomes)是细胞外囊泡(Extracellular vesicles, EVs)的一种,是大小在30-150nm的盘状囊泡,由细胞内的多泡小体(Multivesicular bodies, MVB)与细胞膜融合后,以外泌体的形式释放到细胞外,广泛存在于细胞培养上清以及各种体液中
高质量三维外泌体规模化生产整体解决方案
【概要描述】外泌体(Exosomes)是细胞外囊泡(Extracellular vesicles, EVs)的一种,是大小在30-150nm的盘状囊泡,由细胞内的多泡小体(Multivesicular bodies, MVB)与细胞膜融合后,以外泌体的形式释放到细胞外,广泛存在于细胞培养上清以及各种体液中
- 分类:公司新闻
- 作者:华龛生物
- 来源:华龛生物
- 发布时间:2022-07-05
- 访问量:628

【简介】
外泌体(Exosomes)是细胞外囊泡(Extracellular vesicles, EVs)的一种,是大小在30-150nm的盘状囊泡,由细胞内的多泡小体(Multivesicular bodies, MVB)与细胞膜融合后,以外泌体的形式释放到细胞外,广泛存在于细胞培养上清以及各种体液中[1]。
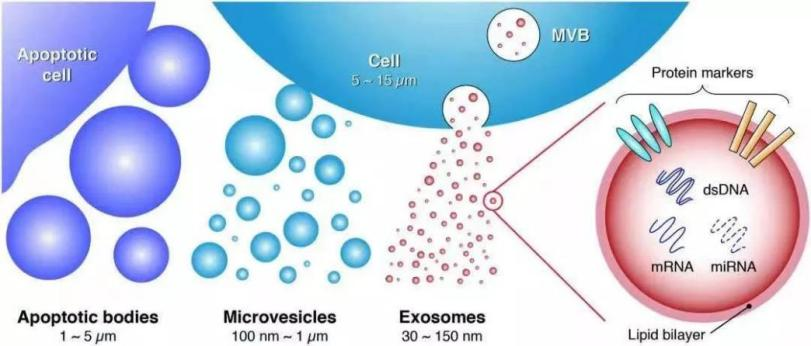
图1 | 细胞外囊泡分类
外泌体携带多种蛋白质、mRNA、miRNA和脂质类物质等,广泛参与细胞间物质运输与信息传递,调控生理和病理过程[2]。首先,由于外泌体体积小,纳米级粒子能穿透一般毛细血管的细胞间隙,因此能很好地被利用。其次,外泌体外膜呈现较少的抗原,免疫系统难识别,无免疫排斥反应,因此,外泌体的临床研究应用越来越广泛。
目前,全球已开展258项与外泌体治疗与诊断相关的临床试验,适应症包括:GvHD,黄斑裂孔,重症新冠肺炎,糖尿病等。此外,外泌体还可以作为“天然的纳米粒子”来进行药物递送[3]。
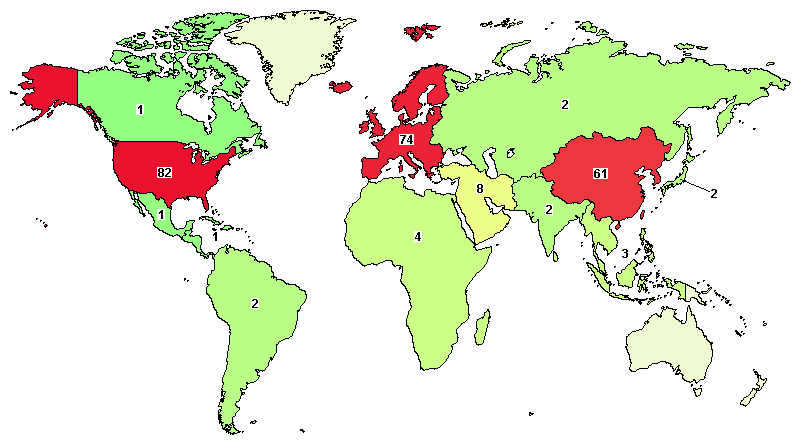
图2 | 外泌体临床实验全球立项分布
图片来源:https://ClinicalTrials.gov
【外泌体商业化关键点】
近年来,为了将外泌体治疗成功推向市场,实现其商业化,有两个关键因素。
1、外泌体“质量”
外泌体的质量关乎于在临床试验中的疗效,那么,分泌外泌体的细胞的质量就尤为重要,3D细胞培养模拟体内生长环境,为细胞提供更适宜生长的三维环境,在细胞的3D培养过程中可随时观察细胞的生长状态,确保细胞保持较高的活性下收集其分泌的外泌体。
2、外泌体“数量”
实现规模化生产外泌体,还极度依赖于其稳定的、经济的、高效的生产制造工艺,实现规模化生产外泌体。相比于传统2D培养+超速离心的方式,要收获可用于临床研究应用的外泌体可能需要花费数周时间,而既要保证外泌体质量,又希望今天之内就可实现自动化大规模收集细胞上清中的外泌体。华龛生物可提供一整套外泌体生产及纯化的解决方案。
【3D FloTrix® 外泌体生产纯化整体解决方案】
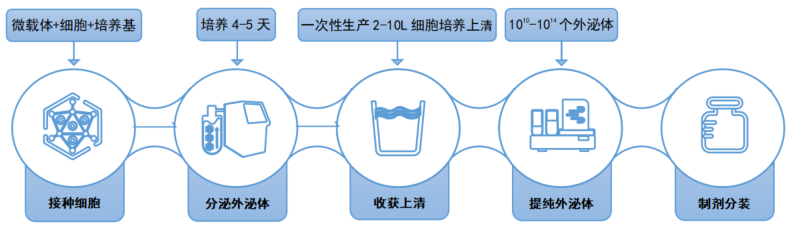
图3 | 外泌体生产纯化流程图
阶段一:3D细胞规模化培养
✦ 细胞:脐带间充质干细胞(UCMSC)
✦ 微载体:3D TableTrix® 干细胞微载片 W系列 S型 (W02)
✦ 培养基:3D FloTrix® 三维细胞培养基(RMZ010-DW)
✦ 培养容器:3D FloTrix® vivaSPIN VS系列生物反应器(FTVS10)
✦ 3D细胞培养周期:5days
✦ 培养结果:一次性收集10L细胞培养上清
✦ 细胞生长情况:
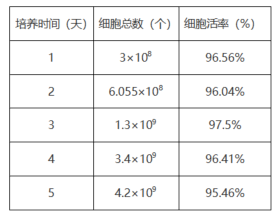
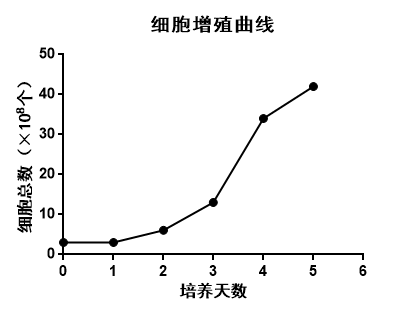
表1 图四|细胞增殖曲线
阶段二:外泌体浓缩收获阶段
✦ 细胞培养上清:10L 3D细胞培养上清
✦ 纯化设备:3D FloTrix® vivaEXO外泌体收获系统
✦ 纯化原理:澄清过滤+浓缩过滤多级过滤系统,收获、富集细胞培养上清中的外泌体。
✦ 使用方法:一次性管路耗材包,配套vivaEXO外泌体收获系统使用,将vivaSPIN生物反应器中的出液管路与vivaEXO外泌体收获系统的进液管路相连,即可实现“培养-收获”全封闭式无缝连接。
✦ 收集时长:10L细胞培养上清浓缩富集20倍,仅需1-3小时(据培养液的粘稠度而定)
✦ 纯化结果:收集500mL高浓度无菌外泌体溶液
阶段三:外泌体鉴定
① 纳米颗粒跟踪分析仪(NTA)检测外泌体粒子浓度及粒径范围:
经过NTA检测外泌体粒子浓度为5.7×1011particles/mL,总颗粒数2.85×1014particles,平均粒径为135nm。
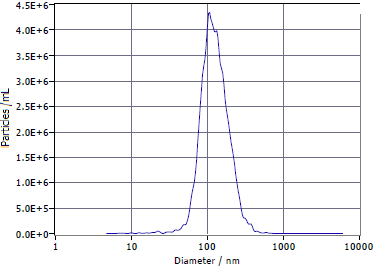
图5 | 外泌体粒径范围
② 免疫印迹(WB)检测3D外泌体表面标志物表达:
外泌体阳性表面标志物:TSG101、CD63有清晰条带,外泌体阴性表面标志物Calnexin无表达。
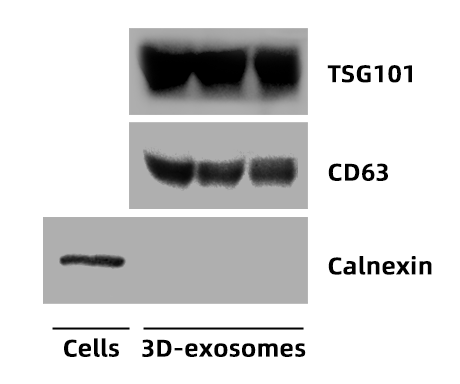
图6 | WB鉴定结果
③ 透射电镜(TEM)观察3D外泌体结构:
TEM显示外泌体呈经典的“杯盘状”结构。
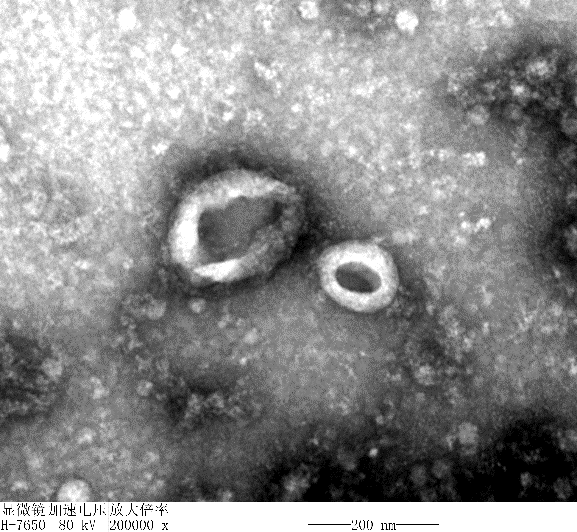
图7 | 外泌体结构
【外泌体应用方向举例】
1、治疗性外泌体作为药物
由于外泌体富含生物活性物质,其本身就有一定的治疗潜力,在医用再生领域被应用于不同的组织修复和再生中。临床研究上已涉及心血管系统、内分泌代谢系统等。除了以上几个领域,干细胞来源的外泌体被应用到了糖尿病、骨关节炎、子宫内膜损伤修复、癌症等多种疾病领域。
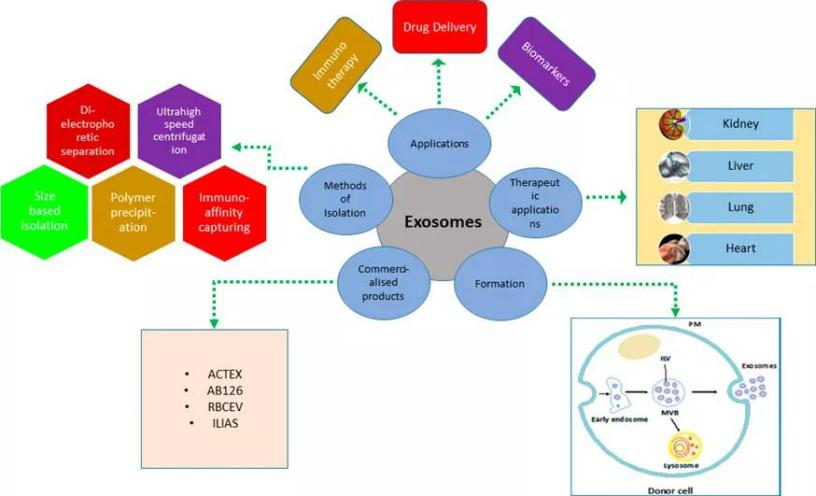
图8 | 外泌体的应用方向
首先,外泌体可以促进细胞的修复和再生。衰老的三大主要原因就是细胞损伤、细胞营养不良、细胞失活,因此如何促进细胞新生是抗衰的关键所在[4]。外泌体能够远距离靶向调控细胞的修复、生长与分化,有效抑制细胞老化。有效运转营养物质渗入细胞,参与细胞更新、调理皮肤、改善肤质,令肌肤恢复年轻、健康的状态。
采用不同培养方式(2D、3D)培养的间充质干细胞,收集其分泌的外泌体进行促细胞增殖实验。将基础培养基中加入不同浓度的外泌体进行细胞(MSC)培养4天后,采用CCK-8试剂盒检测细胞增殖能力。如图9,2D和3D来源的外泌体均有促进细胞增殖的功能,且促细胞增殖能力3D-exosomes优于2D-exosomes。
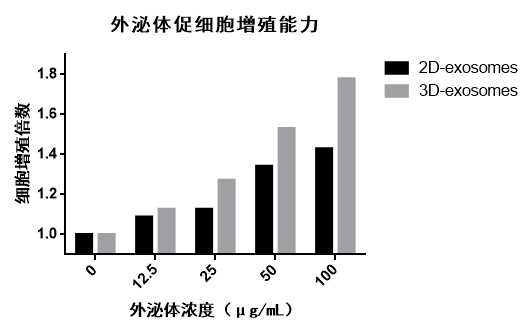
图9 | 2D、3D外泌体促进细胞增殖倍数
再次,外泌体可以促进成纤维细胞增殖。成纤维细胞是皮肤真皮层中的主细胞群,它们的健康和活性关乎着皮肤的健康和美丽。外泌体可以增强成纤维细胞的增殖能力,达到逆转成纤维细胞老化的作用。
同样,采用不同培养方式(2D、3D)培养的间充质干细胞,收集其分泌的外泌体进行促成纤维细胞增殖实验。将组1(图10)和组2(图11)中加入不同浓度的外泌体培养成纤维细胞,采用CCK-8试剂盒检测细胞增殖能力。两组实验中,2D-exosomes和3D-exosomes对成纤维细胞均有增殖作用,且促成纤维细胞增殖能力3D-exosomes优于2D-exosomes。随着外泌体浓度的增加,促增殖能力减弱,外泌体浓度在25μg/mL时展现较好的促增殖效果。
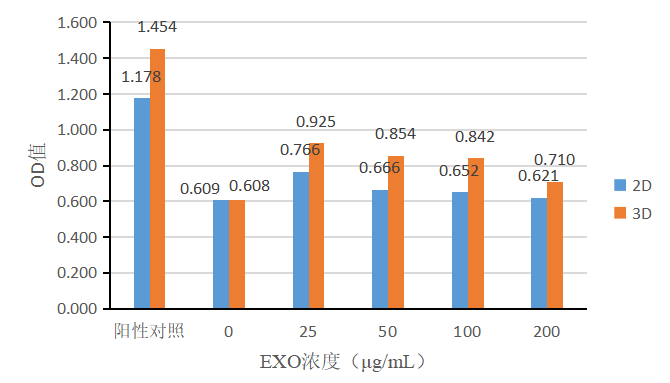
图10 | 基础培养基+不同浓度外泌体促成纤维细胞增殖效果
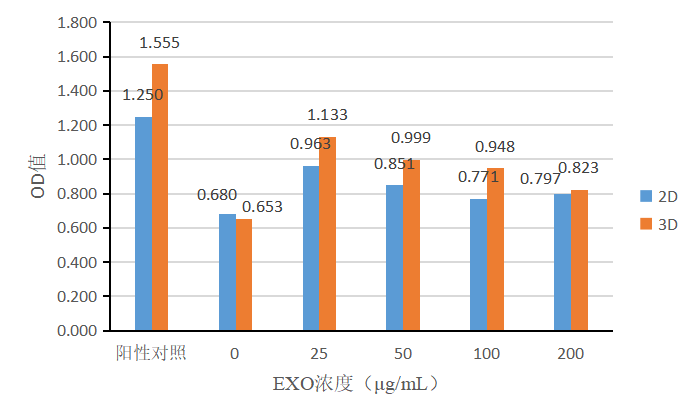
图11 | 含有1%FBS培养基+不同浓度外泌体促成纤维细胞增殖效果
2、外泌体作为给药载体
外泌体作为一种“天然驯化”的内源性纳米载体,可以携带RNA,DNA,蛋白质等信号分子,能够在活体中维持其内含物的生物学活性,且具有免疫源性低,安全性高的特点,因此可以作为治疗性生物大分子的给药载体。例如外泌体可以作为治疗性核酸药物的给药载体,将mRNA、miRNA等传递到靶细胞,从而调控目的基因的表达,来起到治疗作用。
采用不同培养方式(2D、3D)培养的工程化细胞,接种相同细胞数(2D细胞接种密度1×106个/mL,10mL培养基;3D细胞接种密度5×105个/mL,20mL培养基),3D培养收集不同时间的细胞培养上清,收获的工程化细胞分泌的外泌体粒子总数3D-exosomes均比2D-exosomes数量多,且随着3D培养时间的增加外泌体分泌量也增加。图12为2D/3D不同培养方式、不同培养时间分泌的外泌体粒子总数。
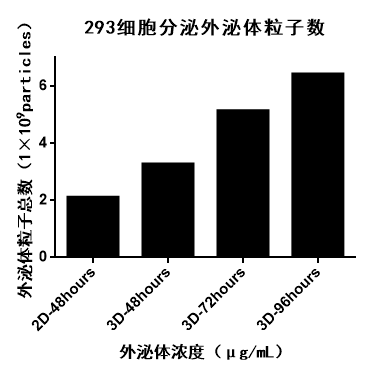
图12 | 外泌体粒子总数
外泌体无论是作为治疗性药物还是作为给药载体,3D培养方式收获的外泌体相较于2D培养方式收获的外泌体在”质量”和”数量“上均展现出了更高的水平。华龛提供的3D培养方式也为外泌体相关科研领域的专家提供了更广阔的研究空间,期待与更多外泌体相关领域研究的爱好者合作,探索3D外泌体的新世界。
【技术服务】
面对细胞培养和收集时的不同导向&节点,华龛也能提供相应技术服务。
1、服务项目
✦ 细胞上清生产服务:大批量生产干细胞、工程化细胞培养上清;
✦ 外泌体纯化服务:细胞上清中的外泌体纯化;
✦ 质量检测服务:细胞上清中微生物、内毒素、支原体、蛋白浓度、细胞分泌因子等检测。外泌体粒子浓度、粒径大小、透射电镜及免疫印迹等外泌体鉴定。
2、服务内容
✦ 提供定制化实验方案;
✦ 定制化三维细胞培养及细胞衍生物收集;
✦ 三维细胞培养工艺优化。
【参考文献】
[1] Breakefield X.O., Frederickson R.M., Simpson R.J. Gesicles: Microvesicle “cookies” for transient information transfer between cells. Mol. Ther. 2011;9:1574–1576.
[2] Yu B, Zhang X, Li X. Exosomes derived from mesenchymal stem cells. Int J Mol Sci. 2014 Mar 7;15(3):4142-57.
[3] Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges. Acta Pharm Sin B. 2016 Jul;6(4):287-96.
[4] Ha DH, Kim HK, Lee J, Kwon HH, Park GH, Yang SH, Jung JY, Choi H, Lee JH, Sung S, Yi YW, Cho BS. Mesenchymal Stem/Stromal Cell-Derived Exosomes for Immunomodulatory Therapeutics and Skin Regeneration. Cells. 2020 May 7;9(5):1157.

留下您的问题和需求,技术人员将会与您进行详尽沟通。
还有机会获得精美好礼~

扫二维码用手机看
推荐新闻
3月回顾︱聚焦两会,CGT产业备受关注
四月活动一览︱春日正盛,邀您共赴!
国内外泌体领域进展总结(2024年3月)
-
电话
- 服务热线400-012 6688
-
E-mail
- E-mailmarketing@cytoniche.com
- TOP
 京公网安备 11010802037749号
京公网安备 11010802037749号



