以下文章来源于外泌体之家(公众号)
新型冠状病毒(新冠病毒,SARS-CoV-2)疫情席卷全球,疫苗接种或治疗性给予中和抗体曾被认为是防治新冠病毒的最佳策略之一。随着新冠病毒的不断变异,病毒的免疫逃逸已成为中和性抗体效价降低的主要原因之一。
2023年1月07日,中科院上海药物所高召兵、李佳,以及武汉病毒所张磊砢、昆明动物所郑永唐联合研究团队在Cell Discovery发表了题为 “Extracellular vesicles mediate antibody-resistant transmission of SARS-CoV-2(一种细胞外囊泡介导的抗体抵抗的新冠病毒传播模式)”的研究论文 (2023 Jan 6;9(1):2),首次报道新冠病毒感染可产生一类新型胞外囊泡(EVs),探寻囊泡起源时发现,SARS-CoV-2的包膜蛋白E形成新型离子通道并诱导产生与病毒感染高度类似的胞外囊泡。该囊泡可装载大量病毒颗粒,不仅保护病毒免受抗体的中和,而且介导病毒以非经典受体hACE-2依赖的模式侵入宿主细胞,产生新的感染。该项研究不仅揭示新冠病毒逃逸中和抗体的新机制,提出新型病毒传播模式,而且为未来的抗病毒治疗提供了潜在靶点。

新冠病毒包膜蛋白 E 形成离子通道并诱导同样的胞外囊泡
新冠病毒包膜蛋白 E(2-E)是该工作首次发现和确证的SARS-CoV-2 离子通道。前期工作中研究者发现 2-E 通道可以诱导宿主细胞发生死亡,促进宿主体内的炎症风暴发生。在探索 SARS-CoV-2 诱导胞外囊泡起源时,研究发现 2-E 通道表达介导的宿主细胞发生焦亡的过程中,导致宿主细胞内膜系统紊乱,造成内膜系统产生膜囊泡,最终以“出泡”的形式分泌到胞外。分泌到胞外的囊泡平均粒径为 4.3 微米;同时发现,由 2-E 通道诱导的囊泡可包裹胞内物质,包括病毒、蛋白等分泌出胞外,并可被健康细胞以膜融合方式再次摄取(图1)。
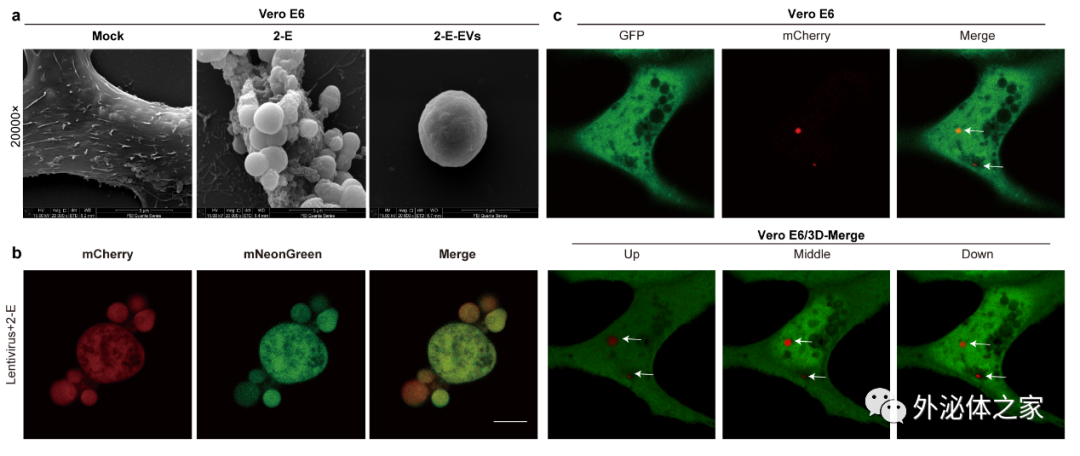
图1. 2-E通道表达诱导宿主细胞产生携带病毒颗粒的大型胞外囊泡
新冠病毒感染诱导产生新型胞外囊泡
研究团队发现新冠病毒感染后可诱导宿主细胞发生“出泡样”死亡,分泌与 2-E表达类似的大型囊泡,分泌到胞外的囊泡粒径远远大于所有已知的其它类型的胞外囊泡。扫描电镜下该囊泡光滑成球形,粒径统计发现该囊泡直径可达4.9微米,远远超出已报道的外泌体、微体以及凋亡小体等三种经典胞外囊泡(图2a)。研究团队通过透射电镜观察病毒感染后细胞超微结构的变化,发现该囊泡不仅可携带大量肿胀受损的细胞器,而且可携带大量的病毒颗粒,并获免疫电镜证实(图2b)。病毒噬斑以及qRT-PCR实验进一步证实该囊泡中的病毒为活病毒粒子,具有感染能力(图2c)。
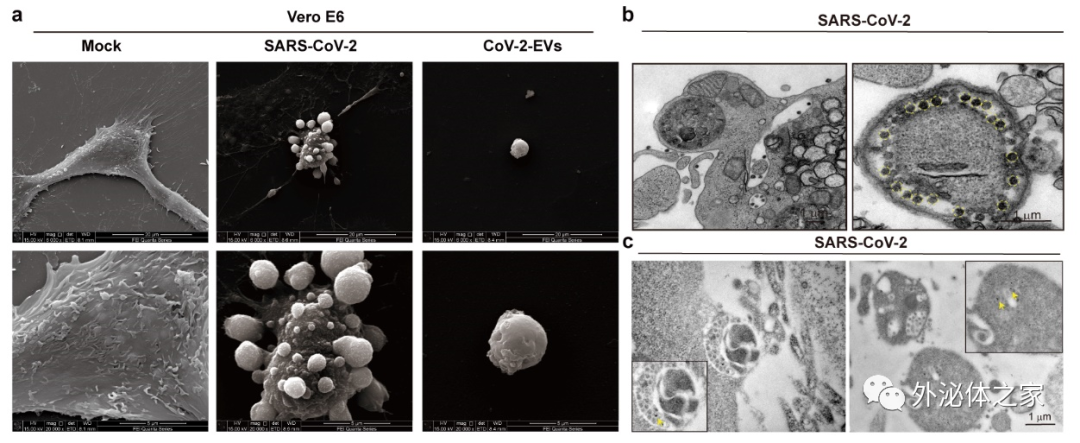
图2. 新冠病毒感染诱导宿主细胞产生携带病毒颗粒的大型胞外囊泡
新型胞外囊泡协助病毒逃避中和抗体攻击
新冠病毒产生的胞外囊泡可以包裹成熟病毒颗粒,因此推测“胞外囊泡可能成为新冠病毒逃避中和抗体识别和攻击的保护伞”。研究者选用两类已经报道的新冠病毒中和抗体,在验证了其中和效率的基础上,进行了概念性验证。在细胞水平模拟感染后中和抗体的治疗过程,通过比较抗体治疗与不治疗组别中细胞内部、上清以及分离的胞外囊泡中的病毒滴度,结果显示,尽管上清液中的游离病毒可以被中和抗体抑制,但两种抗体均不能降低胞外囊泡中活病毒水平,显示胞外囊泡可帮助其中的新冠病毒逃避中和抗体的识别和攻击(图3)。
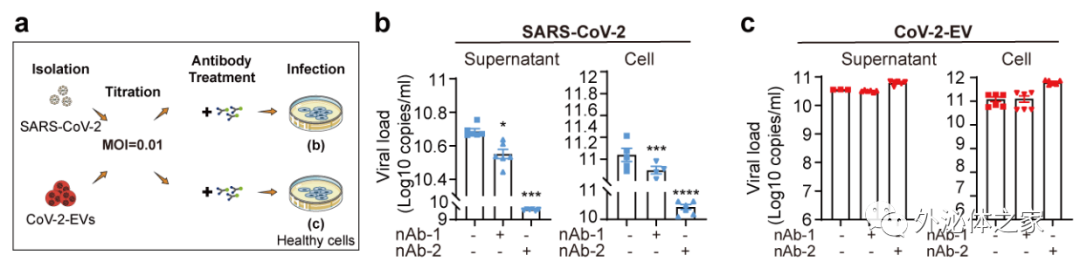
图3. 胞外囊泡介导抗体逃逸
新型胞外囊泡介导非受体依赖的病毒传播
新冠病毒生命周期始于刺突蛋白(S)与宿主细胞表面的受体血管紧张素转化酶2(ACE-2)的结合;跨膜丝氨酸蛋白酶2(TMPRSS2)对S1 / S2位点的切割和溶酶体L-蛋白酶介导的病毒-细胞膜融合决定了病毒进入的效率。值得注意的是,与一些肺外组织相比,肺细胞中的hACE-2表达较低,但新冠病毒可以引起严重的肺感染;在COVID-19患者的肺中,hACE-2的表达没有上调;而不表达hACE-2的组织同样可被侵袭。由此可见,新冠病毒存在细胞进入的未知途径,胞外囊泡可能成为潜在活病毒进入细胞的新机制。研究者选用了新冠病毒已知受体高表达细胞株VeroE6与低表达细胞株A549、SCC7作为模式细胞探究胞外囊泡的再感染能力。结果显示,不表达hACE-2受体的两株细胞不可被新冠病毒活病毒直接侵袭,却可被胞外囊泡感染,并可继发产生完整的病毒颗粒。由此说明,新冠病毒感染诱导的胞外囊泡介导一种不依赖于受体的新型传播方式(图4)。
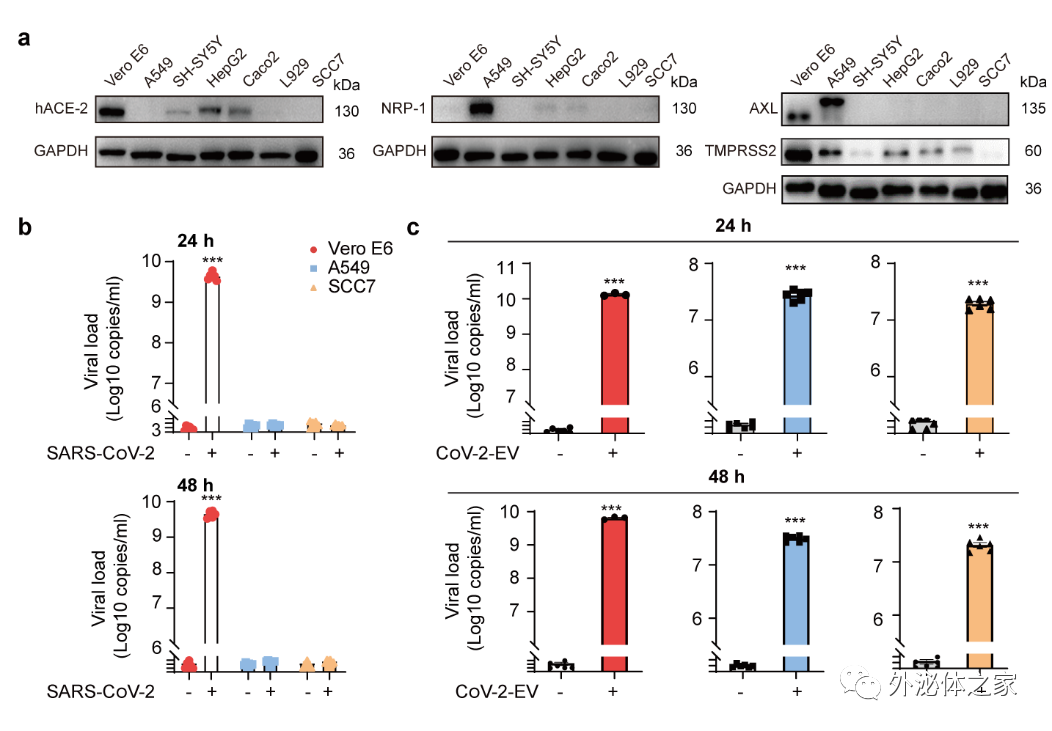
图4. 胞外囊泡介导非受体依赖的病毒传播
综上所述,高召兵/李佳/张磊砢/郑永唐联合研究团队发现并证明了新冠病毒感染后可诱导宿主细胞产生一类新型胞外囊泡。该囊泡可包裹大量病毒颗粒,协助新冠病毒逃避中和抗体攻击,并直接以膜融合的方式介导病毒传播(图5)。作为首个发现的新冠病毒诱导的新型胞外囊泡,其介导抗体抵抗、非受体依赖的传播新模式,是该领域的重要创新发现之一;其次该研究首次将病毒自身离子通道功能与宿主内膜系统变化相关联,提出了通道潜在的新功能。该研究的实现突破了目前对新冠病毒传播和抗体抵抗的原有认知,可能为新冠病毒传播机制、抗体设计、抗病毒治疗提供新的科学依据,并为以囊泡为治疗靶点的抗病毒药物研发奠定基础。
图5. 囊泡介导、抗体抵抗、非受体依赖的SARS-CoV-2传播示意图
上海药物所夏冰清副研究员、博士生申许瑞、武汉病毒所潘晓彦副研究员、昆明动物所罗荣华博士为该论文的共同第一作者。上海药物所高召兵研究员、李佳研究员,夏冰清副研究员以及武汉病毒所张磊砢副研究员、昆明动物所郑永唐研究员为共同通讯作者。研究工作同时得到武汉病毒所肖庚富研究员的支持和帮助。共同作者还包括联合研究团队其它成员。该工作得到国家重点研发计划、国家自然科学基金委、上海市科委以及中科院青年创新促进会等项目的资助。
参考文献:
Extracellular vesicles mediate antibody-resistant transmission of SARS-CoV-2, Cell Discov. 2023 Jan 6;9(1):2. doi: 10.1038/s41421-022-00510-2.
【华龛生物】
北京华龛生物科技有限公司由清华大学医学院杜亚楠教授科研团队领衔创建,清华大学参股共建。核心技术源于清华大学的科技成果转化。公司专注于打造原创3D细胞“智造”平台,提供基于3D微载体的细胞规模化定制化扩增工艺整体解决方案。
华龛生物核心产品3D TableTrix®微载体(片剂),是自主创新型、首款可用于细胞药物开发的药用辅料级微载体。已通过中检院等相关权威机构的检验报告,并获得2项国家药监局药用辅料资质(CDE审批登记号:F20210000003、F20200000496)。同时,产品获得美国FDA DMF药用辅料资质(DMF:35481)。
华龛生物的产品与服务,可广泛应用于基因与细胞治疗、细胞外囊泡、疫苗及蛋白产品等生产的上游工艺开发。同时,在再生医学、类器官与食品科技(细胞培养肉等)领域也具有广泛应用前景。
公司拥有5000余平米的研发与转化平台,其中包括1000余平的以3D细胞智造及微组织再生医学治疗产品为核心的CDMO服务平台;还拥有4000平米的GMP生产平台,并新建1200L微载体生产线。相关技术已获得100余项专利成果,30余篇国际期刊报道。核心技术项目已获得多项国家级立项支持与应用。

扫二维码用手机看
推荐新闻
⏳倒计1天 | 2024细胞治疗产品智造及商业化策略系列研讨会(上海站)等您来参加
⏳倒计3天 | 2024细胞治疗产品智造及商业化策略系列研讨会(上海站)等您来参加
-
电话
- 服务热线400-012 6688
-
E-mail
- E-mailmarketing@cytoniche.com
- TOP
 京公网安备 11010802037749号
京公网安备 11010802037749号



